抗體應(yīng)用和技術(shù)

抗體是用于各種實驗室技術(shù)的強大研究工具�����。在此����,我們將簡要介紹最流行的實驗室技術(shù),重點介紹它們?nèi)绾问褂每贵w��。
酶聯(lián)免疫吸附實驗(ELISA)
ELISA是一種基于平板的技術(shù)���,可以檢測生物樣本中的抗原����。與其他免疫測定方法一樣,ELISA依靠抗體與抗原的高度特異性相互作用來檢測目標(biāo)抗原�����。ELISA可以對分析物和分子相互作用進(jìn)行定量和定性����。
在酶聯(lián)免疫吸附實驗中,抗原被直接固定在固體表面上����,或者更常見的是通過捕獲抗體固定在表面上(圖1)。表面經(jīng)過洗滌�����,然后與酶或熒光團(tuán)等分子連接的檢測抗體一起孵育����。
在抗原存在的情況下,這些檢測抗體會與平板保持結(jié)合�,產(chǎn)生信號。信號的強度與樣本中的抗原濃度相對應(yīng)����。

圖1:夾心酶聯(lián)免疫吸附實驗裝置����。多孔板上的捕獲抗體將固定感興趣的抗原����。與生物素和鏈霉親和素-HRP結(jié)合的檢測抗體將識別并結(jié)合該抗原。
ELISA通常在多孔板(96孔或384孔)中進(jìn)行���,分析物的固定化有助于將抗原與其他樣品成分分離。這些特點使ELISA成為最容易同時對多個樣品進(jìn)行檢測的方法之一���。
酶聯(lián)免疫吸附法主要有四種:直接法�����、間接法���、夾心法和競爭法,每種方法都有其獨特的優(yōu)缺點和適用性����。每種實驗最合適的酶聯(lián)免疫吸附實驗形式取決與許多因素,包括所需的靈敏度、特異性和檢測時間���。
酶聯(lián)免疫斑點檢測
酶聯(lián)免疫斑點(ELISPOT)用于檢測細(xì)胞分泌的蛋白質(zhì)�,如細(xì)胞因子和生長因子�����。該技術(shù)可以量化和比較對各種刺激的免疫反應(yīng)���。
將細(xì)胞培養(yǎng)在96孔板中�����,使用抗體包被的PVDF或硝酸纖維素膜�。使用一抗和共軛二抗檢測相關(guān)分泌蛋白��。分泌相關(guān)蛋白的細(xì)胞會出現(xiàn)色斑或熒光��。掃描并分析膜�����,量化分泌蛋白質(zhì)的細(xì)胞數(shù)量或比例�。
免疫印跡(WB)
免疫印跡技術(shù)廣泛應(yīng)用于分離和鑒定蛋白質(zhì)的研究��。通過免疫印跡��,我們可以檢測蛋白質(zhì)�����,確定不同樣本之間的相對蛋白質(zhì)水平��,并確定目標(biāo)蛋白質(zhì)的分子量���,從而深入了解蛋白質(zhì)的翻譯后加工過程。
免疫印跡包括三個主要步驟:(1)按大小分離蛋白質(zhì)�,(2)將蛋白質(zhì)轉(zhuǎn)移到膜上,(3)使用一抗和二抗觀察目標(biāo)蛋白質(zhì)(圖2)����。
第一步�����,將蛋白質(zhì)裝載到凝膠上�,通過凝膠電泳按大小進(jìn)行分離。然后利用電流將蛋白質(zhì)條帶遷移到膜上�。蛋白質(zhì)轉(zhuǎn)移到膜上至關(guān)重要,因為用于電泳的凝膠為隨后的免疫染色提供了一個較差的表面,即抗體不會粘附在凝膠的蛋白質(zhì)上����。
最后,用特異性抗體對膜進(jìn)行進(jìn)一步免疫染色�����,并用二抗和檢測試劑對膜進(jìn)行顯像���。
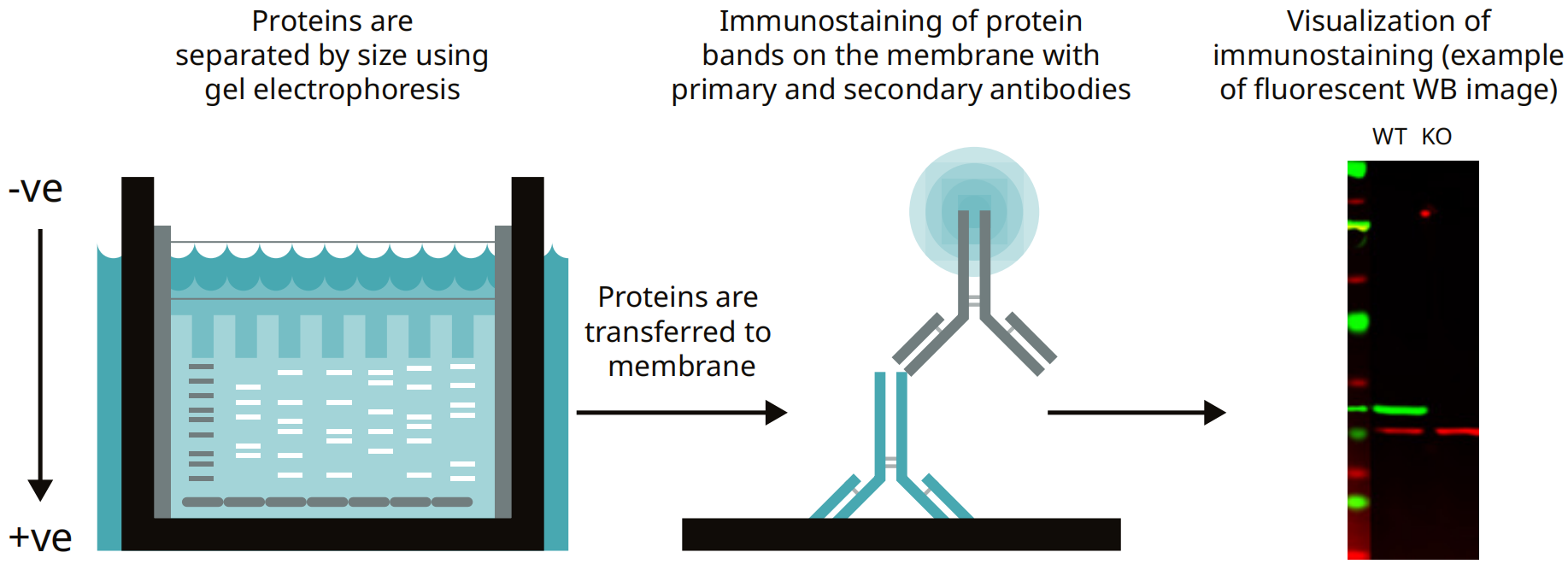
圖2:免疫印跡簡圖
免疫沉淀(IP)和染色質(zhì)免疫沉淀(ChIP)
免疫沉淀(IP)是一種分離和純化單個蛋白質(zhì)和復(fù)合蛋白質(zhì)的多功能技術(shù)���。在這項技術(shù)中,抗體被固定在固相基質(zhì)(如磁珠/瓊脂糖珠)上���,從復(fù)雜的溶液中捕捉抗原�。
染色質(zhì)免疫沉淀(ChIP)用于確定特定蛋白質(zhì)是否與體內(nèi)特定DNA序列結(jié)合�。通過ChIP,研究人員可以確定感興趣的蛋白質(zhì)在整個基因組中結(jié)合的特定基因和系列��,為了解其調(diào)控功能和機制提供重要線索���。

圖3:ChIP方案工作流程��。進(jìn)行ChIP實驗的步驟:1.交聯(lián)����,2.染色質(zhì)片段化,3.免疫沉淀���,4.DNA 回收和純化�,5.DNA 分析��。
免疫組織化學(xué)(IHC)
免疫組織化學(xué)(IHC)是一種利用抗體-抗原相互作用來檢測組織切片中抗原分布和定位的方法(圖4)�����。雖然定量效果不如免疫印跡或ELISA��,但I(xiàn)HC具有在完成組織中鑒定蛋白質(zhì)表達(dá)的優(yōu)勢��。
IHC通常用于診斷癌癥等疾病的組織異常�,IHC提供了寶貴的視角和支持�。
IHC染色依賴于能識別目標(biāo)抗原的抗體。您可以使用顯色或熒光檢測系統(tǒng)來觀察抗體于抗原之間的相互作用����。在色原檢測中���,抗體與酶結(jié)合,當(dāng)抗體接觸色原是會產(chǎn)生彩色沉淀����。在熒光檢測中,抗體與熒光團(tuán)結(jié)合��。樣品制備和可視化技術(shù)多種多樣�����,所使用的方法應(yīng)根據(jù)樣本類型和所需的靈敏度而定��。

圖4:左圖為正常人扁桃體組織(福爾馬林固定石蠟包埋切片)的熒光多重IHC染色�����??筆D1(橙色)、抗PDL1(綠色)�����、抗CD68(黃色)���、抗CD3(紅色)�����、抗Ki67(淡藍(lán)色)和抗PanCK(灰色)的合并染色�����。右圖為用抗Ki67抗體對福爾馬林固定石蠟包埋的正常人扁桃體切片進(jìn)行IHC染色��。
免疫細(xì)胞化學(xué)(ICC)
免疫細(xì)胞化學(xué)(ICC)是利用標(biāo)記抗體研究蛋白質(zhì)的亞細(xì)胞分布���。與IHC不同的是��,這種技術(shù)側(cè)重于細(xì)胞樣本而不是組織塊���。
在ICC染色中,針對相關(guān)蛋白質(zhì)的抗體被應(yīng)用于經(jīng)過固定和通透處理的細(xì)胞培養(yǎng)樣本�。ICC有兩種類型:直接和間接。直接ICC使用的是共軛的一抗��,而間接ICC使用的是未共軛的一抗�,然后用共軛的二抗進(jìn)行檢測(圖5)���。在大多數(shù)ICC實驗中���,抗體都用熒光團(tuán)標(biāo)記�����,非常適合共定位研究��。各種成像技術(shù)�����,如寬場顯微鏡�����、共聚焦顯微鏡或旋轉(zhuǎn)圓盤顯微鏡都可用于檢測信號���。

圖5:左圖是用抗PDGFRA抗體(用Alexa Flour®488二抗檢測-綠色)和抗微管蛋白抗體(用Alexa Fluor®594二抗檢測-紅色)對SH-SY5Y細(xì)胞進(jìn)行間接ICC染色。右圖是用共軛的抗KRT14抗體(Alexa Fluor®647-紅色)和共軛的抗微管蛋白抗體(Alexa Fluor®488-綠色)進(jìn)行直接ICC檢測��。細(xì)胞核用DAPI(藍(lán)色)染色���。上圖顯示野生型細(xì)胞中的相關(guān)信號���,下圖顯示基因敲除沒有的特定信號��。圖像由共聚焦顯微鏡拍攝��。
流式細(xì)胞儀和熒光激活細(xì)胞分揀
流式細(xì)胞儀是一種常用的激光技術(shù)���,用于分析細(xì)胞或顆粒的特征(圖13)。該技術(shù)測量混合群體中與單個細(xì)胞結(jié)合的標(biāo)記抗體發(fā)出的熒光�����。此外��,不同細(xì)胞對光的散射也可用于確定它們的大小和特性�����。

圖6:流式細(xì)胞儀概覽�����。
通過流式細(xì)胞儀��,可以分析細(xì)胞表面和細(xì)胞內(nèi)分子的表達(dá),確定異質(zhì)細(xì)胞群中不同細(xì)胞類型的特征���,評估分離亞群的純度,分析細(xì)胞大小和體積��。它可同時對單個細(xì)胞進(jìn)行多參數(shù)分析����。
熒光激活細(xì)胞分揀(FACS)是流式細(xì)胞術(shù)的一種衍生技術(shù),它根據(jù)熒光標(biāo)記將細(xì)胞群物理分離成亞群����。
參考文獻(xiàn)
1 Bonifacino, J.S., and Dell'Angelica, E.C. (2001). Immunoprecipitation. Curr. Protoc. Cell Biol. Chapter 7, Unit 7.2.
2 Harlow, E., and Lane, D. (1988). Antibodies: A Laboratory Manual. Cold Spring Harbor Laboratory Press.
3 Gundry, R.L., and White, M.Y. (2010). Immunoprecipitation. In: Protein Chromatography: Methods and Protocols, eds. R. Gundry and M.Y. White, pp. 189-203. Humana Press.
4 Towbin H, Staehelin T, Gordon J. (1979) Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76(9):4350-4.
5 Taylor, C. R., & Levenson, R. M. (2006). Quantification of immunohistochemistry—issues concerning methods, utility and semiquantitative assessment II. Histopathology, 49(4), 411-424.
6 Van Weemen, B. K., & Schuurs, A. H. (1971). Immunoassay using antigen-enzyme conjugates. FEBS letters, 15(3), 232-236.