分析測試服務
一、化合物高分辨質譜分析
化學單體質譜分析(正常反饋時間1天)
組分系列化合物質譜分析(正常反饋時間3-5天)
復雜樣品和化藥雜質分析(二維色譜分析)
二�����、化合物標定
1.質量平衡法
含量=HPLC純度*[100%-水分%-溶殘%-熾灼殘渣%]
或含量=HPLC純度*[100%-干燥失重%-熾灼殘渣%]
2.核磁定量法
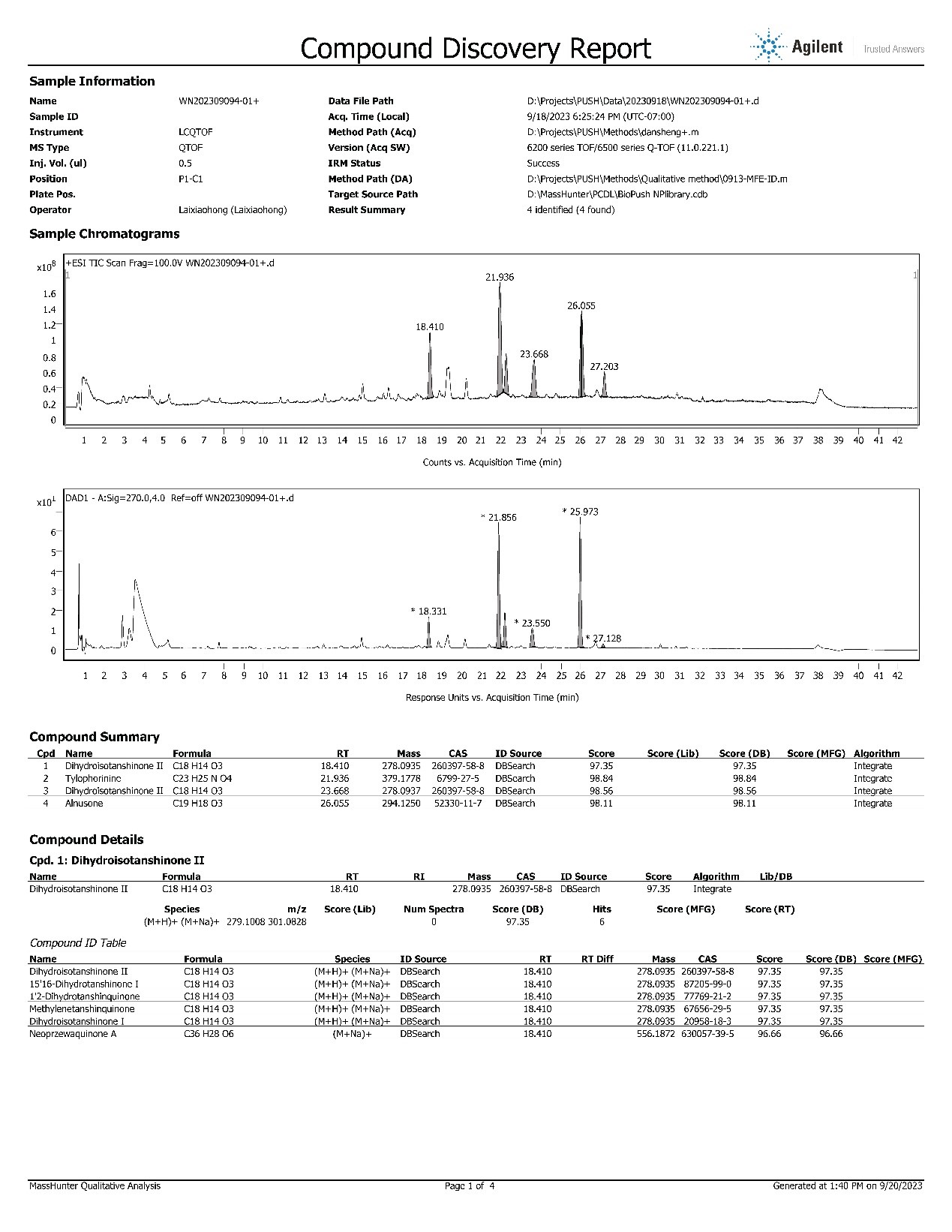
三、化合物結構鑒定
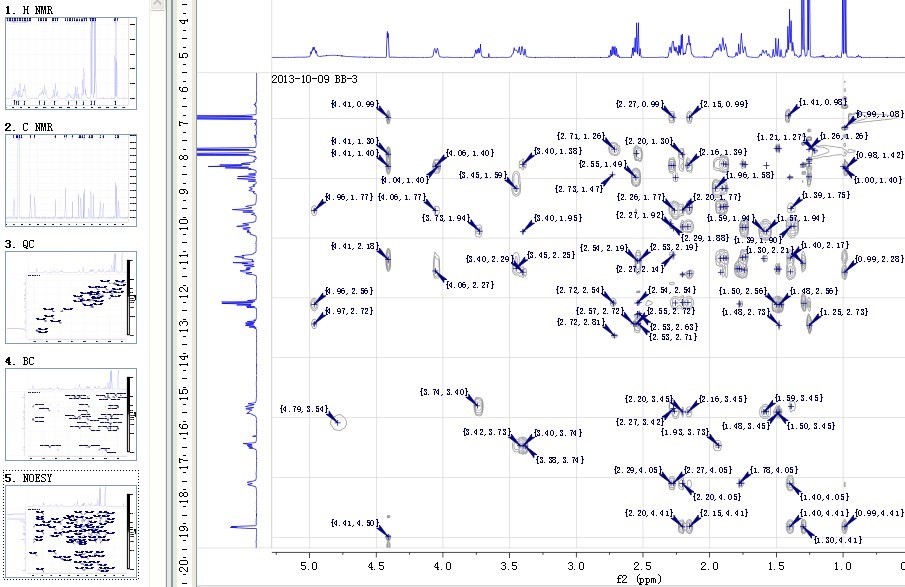
利用UV����、IR、MS����、(1H13,C)NMR、HSQC����、HMBC、NOESY��、COSY�����、CD��、X-ray等現(xiàn)代波譜技術�,對化合物平面結構及立體結構進行研究。
四��、中藥材檢測(CNAS認可)
中藥材常規(guī)檢測項目(約30項)均包含在CNAS認可能力范圍以內(nèi)。自2019年1月通過初評后����,又連續(xù)3次通過復評審,并且每年參加中檢院組織的能力驗證�����,獲得滿意結果10次以上����,檢測結果持續(xù)準確可靠����。

分離純化服務
一、藥材化學成分系統(tǒng)分離
綜合提取���、分離����、色譜和質譜分析等方法����,對藥材/植物內(nèi)特征成分進行系統(tǒng)化研究����,深入系統(tǒng)的發(fā)現(xiàn)植物藥效物質成分��。一般完成周期約6-8周��。
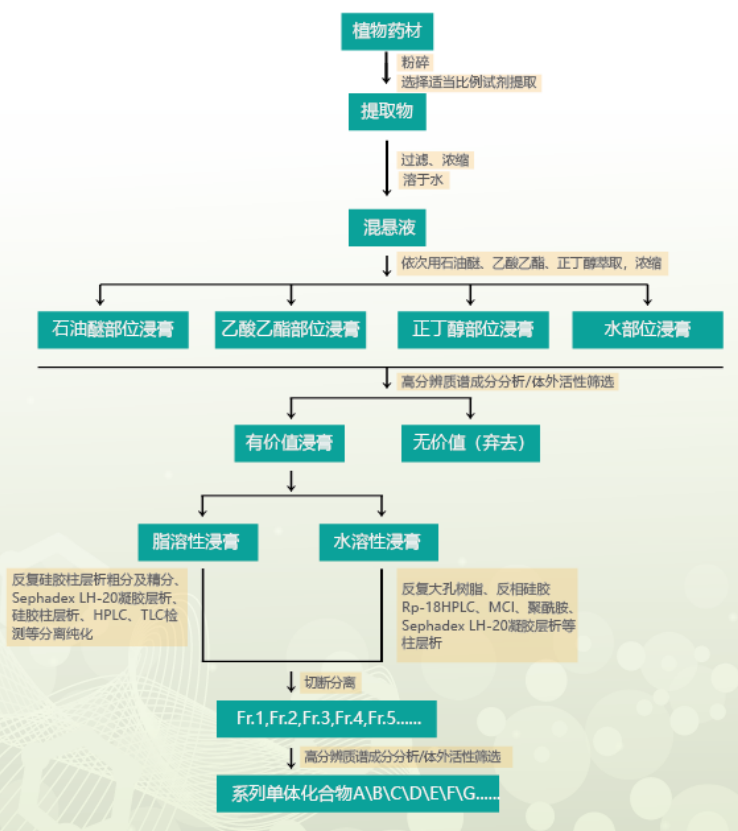
二�����、天然產(chǎn)物/雜質定制分離
先對原料進行成分初步分析再制定純化方案��,主要通過色譜分離方法����,對制定目標單一成分或系列成分進行分離(包含百克級-KG級原料的生產(chǎn))。一般完成周期5-30個工作日���。
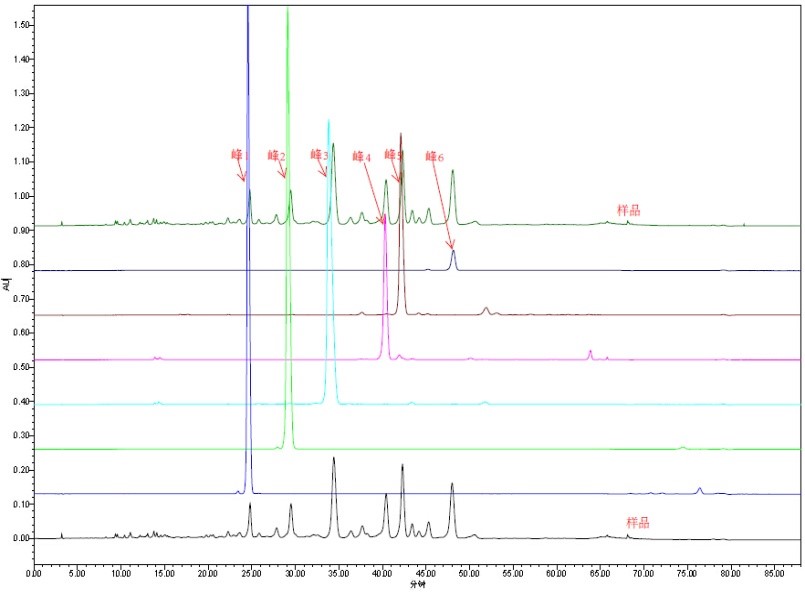
三���、天然產(chǎn)物半合成
通過天然產(chǎn)物中的部分結構元素或中間體,用化學合成的方法來構建目標化合物���。優(yōu)勢在于有效利用天然產(chǎn)物中的已有結構���,減少分離成本和全合成的步驟�。一般完成周期2-4周�����。
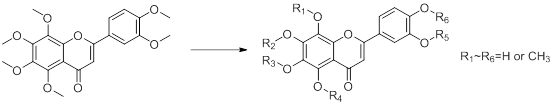
四��、藥品標準物質申報(對照品/對照藥材)
為了保證藥品的質量和安全�,藥檢部門需提前獲得核準的藥品標準中新增標準物質原料及有關研究資料,按照《藥品注冊檢驗程序和技術要求規(guī)范》中相關要求�,藥品生產(chǎn)單位需進行藥品標準物質原料申報備案����。一般完成周期6-8周。
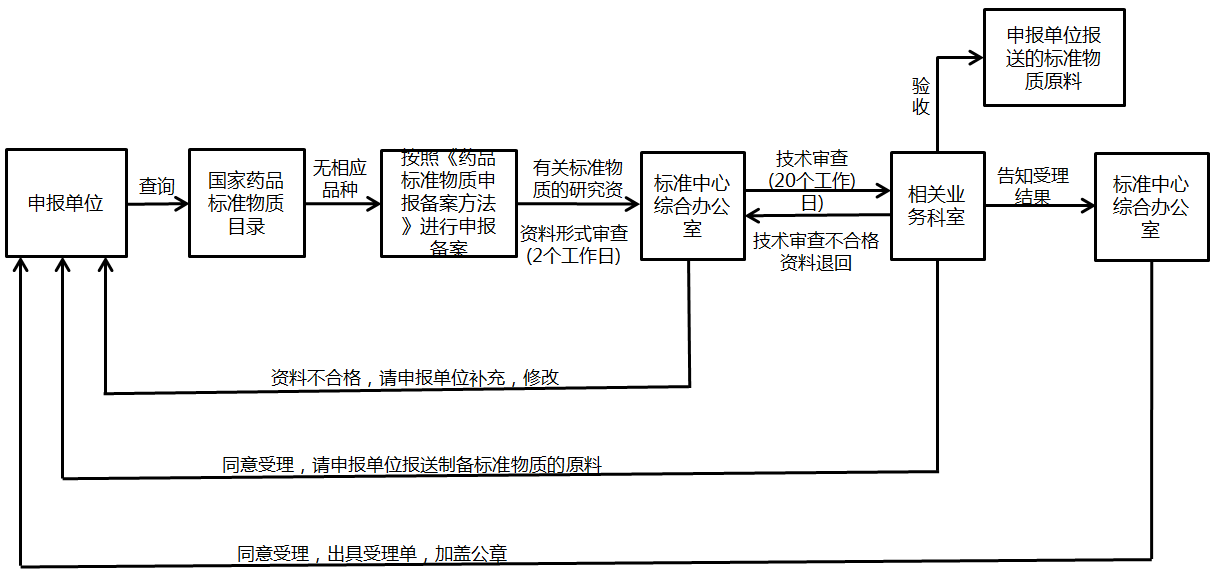
藥物技術服務
核心業(yè)務
竭誠為企業(yè)提供包括中藥新藥研發(fā)��、同名同方及經(jīng)典名方等中藥研發(fā)的優(yōu)質研發(fā)技術服務�。根據(jù)中醫(yī)藥特點和中藥“三結合”審評體系要求,幫助企業(yè)布局中藥新藥研發(fā)戰(zhàn)略規(guī)劃����、開展中藥新藥立項評估、設計新藥研發(fā)路徑和研究計劃�,降低中藥新藥研究風險�����。
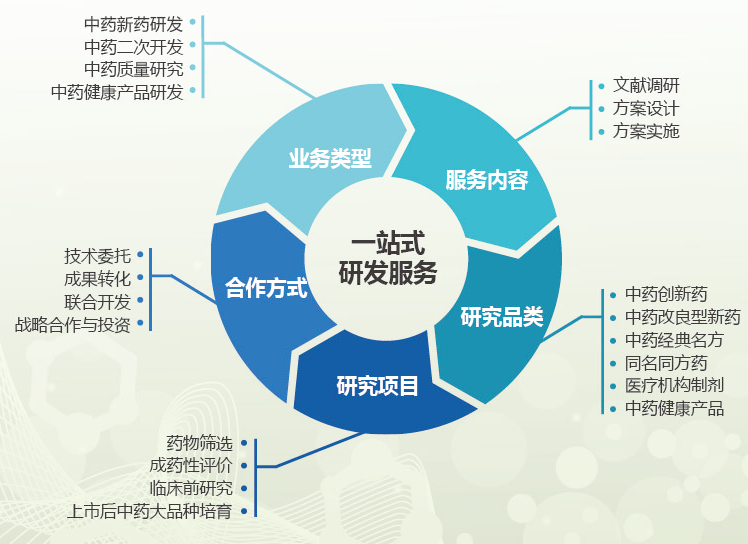
服務項目
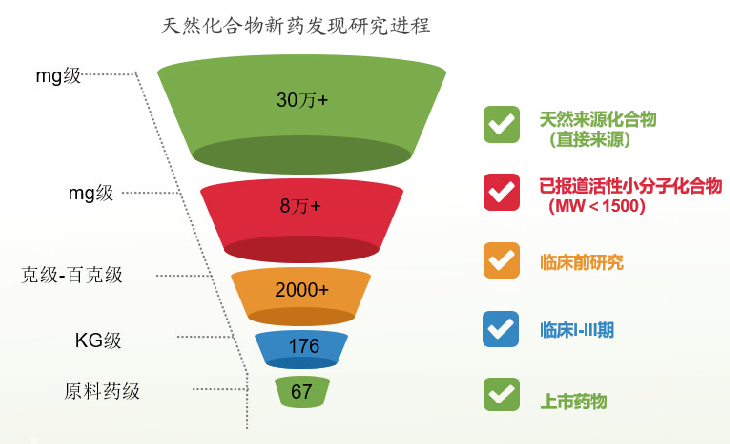
1. 中藥新化合物發(fā)現(xiàn)與活性篩選研究
包括天然活性成分��、中藥提取物及中藥復方制劑等在內(nèi)的新藥探索期的活性篩選及藥效學研究�,從而為其能否進行新藥開發(fā)提供判定依據(jù)���。
2. 中藥新藥臨床前系統(tǒng)研究
基于現(xiàn)行中藥新藥注冊管理辦法及相關指導原則�,開展包括臨床前藥學����、藥效學、安全性評價等在內(nèi)的系統(tǒng)研究�,為新藥臨床注冊申報及IND獲取提供依據(jù)。
3. 經(jīng)典名方研究
基于現(xiàn)行經(jīng)典名方研究指導原則��,開展經(jīng)典名方物質基準研究��、制劑工藝及質量研究�、安全性評價研究等,并協(xié)助企業(yè)開展生產(chǎn)放大研究和進行注冊申報�。
4. 改良型新藥及同名同方藥開發(fā)研究
按照現(xiàn)行中藥注冊管理辦法,開展以臨床應用優(yōu)勢為導向的改良型新藥和以質量一致性為導向的同名同方藥研究��。
5. 組分中藥的配伍研究及高端制劑研究
按照中醫(yī)理論開展活性配伍篩選,確定最佳活性配伍比例���,完成臨床前藥學各項研究�����。
▽▽想了解更多信息請點擊普思官網(wǎng)查看
www.push-herbchem.com
咨詢聯(lián)系:18080489829(微信同號)�,3004654993(qq)