一���、什么是TCR-T細(xì)胞療法?
目前�����,腫瘤免疫治療方興未艾�,群雄并起�,其中最有效的治療策略之一就是過(guò)繼細(xì)胞轉(zhuǎn)移療法(ACT)。嵌合抗原受體(CAR)和工程化T細(xì)胞受體(TCR)是近年來(lái)主要的過(guò)繼性T細(xì)胞免疫療法����。
TCR(T cell receptor)是T細(xì)胞表面的特異性受體,其α鏈和β鏈由高質(zhì)量���、高親和力的抗原特異性T細(xì)胞克隆產(chǎn)生���,以非共價(jià)鍵與CD3結(jié)合,形成TCR-CD3復(fù)合物���,通過(guò)識(shí)別并結(jié)合MHC呈遞的抗原從而激活T細(xì)胞,促進(jìn)T細(xì)胞的分裂與分化�����;其作用機(jī)制是向普通T細(xì)胞中引入新的基因,使得改造過(guò)的T細(xì)胞能夠表達(dá)有效識(shí)別腫瘤細(xì)胞的TCR�����,從而引導(dǎo)T細(xì)胞殺死腫瘤細(xì)胞���。
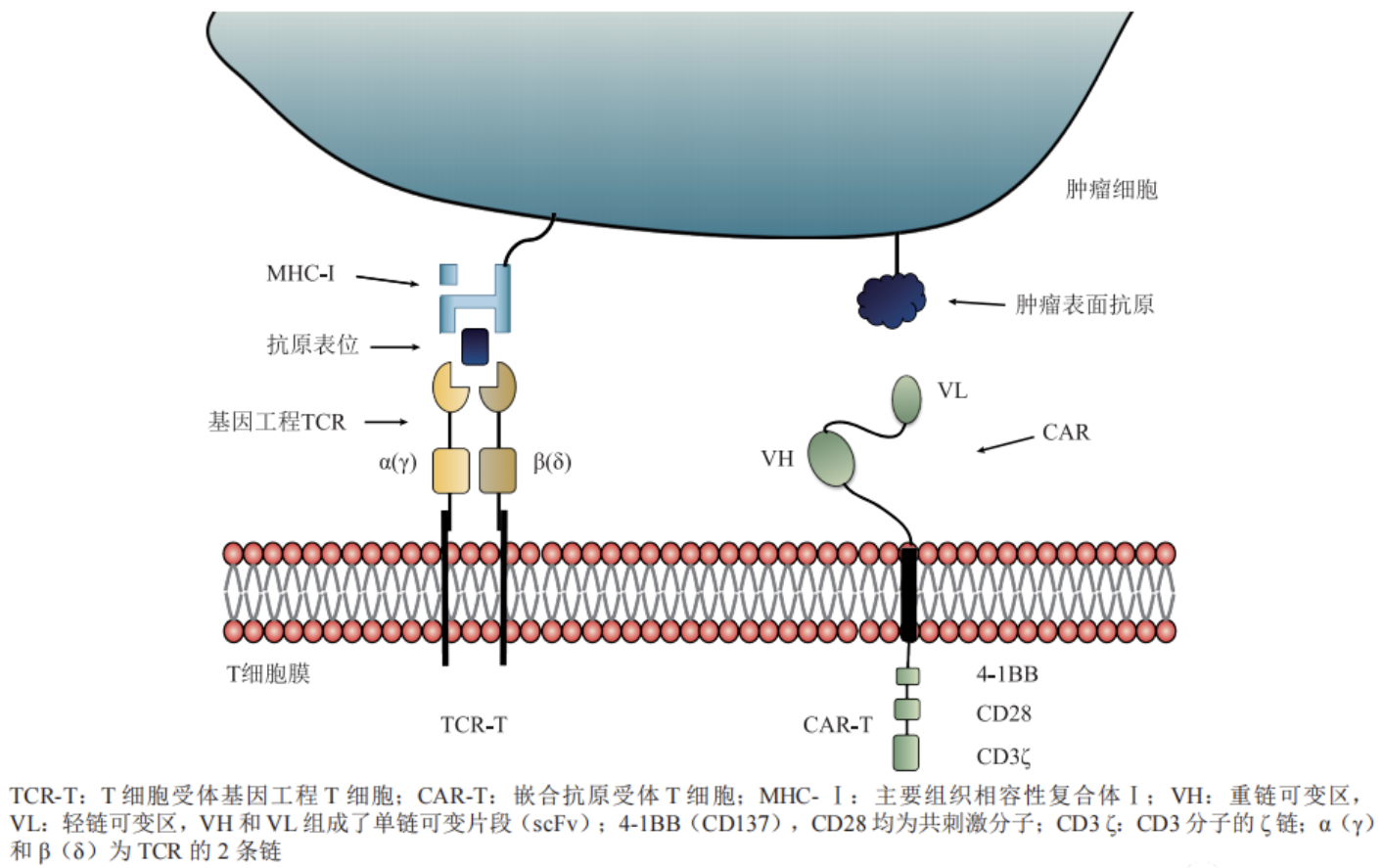
圖1 TCR-T 和CAR-T細(xì)胞結(jié)構(gòu)示意圖
TCR-T療法的操作流程可分為以下4步:
1���、鑒定出一種或多種腫瘤抗原作為治療靶點(diǎn);
2���、獲得特異識(shí)別腫瘤抗原的的TCR序列�;
3���、采用基因工程技術(shù)�����,將編碼抗原特異的TCR基因序列導(dǎo)入患者自身T細(xì)胞中��,從而獲得特異識(shí)別腫瘤抗原的TCR-T細(xì)胞���;
4���、TCR-T細(xì)胞通過(guò)體外培養(yǎng)進(jìn)行大量擴(kuò)增之后,被回輸?shù)交颊唧w內(nèi)以殺死腫瘤細(xì)胞���。
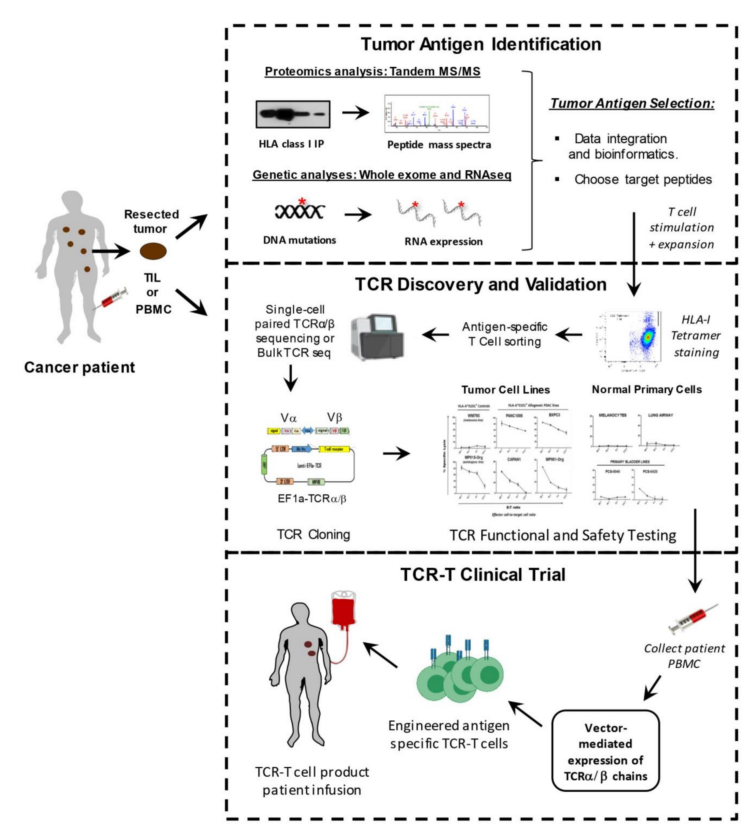
圖2 TCR-T 細(xì)胞治療流程圖
二�����、TCR-T細(xì)胞療法與CAR-T細(xì)胞療法的區(qū)別
(1) 其一在于都是通過(guò)基因改造的手段提高T細(xì)胞受體對(duì)特異性癌癥細(xì)胞抗原的識(shí)別能力和進(jìn)攻能力���,因此都被統(tǒng)稱(chēng)為“T細(xì)胞受體重新定向”技術(shù)(T cell receptor redirection);
(2) 其二是治療流程類(lèi)似�����,都是對(duì)患者自身的T淋巴細(xì)胞進(jìn)行體外改造�,然后回輸?shù)交颊唧w內(nèi)。
(1) 在于對(duì)腫瘤細(xì)胞的識(shí)別機(jī)制���。兩者雖然都是對(duì)患者的T細(xì)胞進(jìn)行體外改造��,再回輸至患者體內(nèi)����,但CAR-T依靠的是人工設(shè)計(jì)的單鏈抗體片段(CAR)���,只能識(shí)別腫瘤表面的抗原�����,通過(guò)胞內(nèi)共刺激分子傳遞信號(hào)��,進(jìn)而激活T細(xì)胞��。而TCR-T則更類(lèi)似于人體中天然的T細(xì)胞�����,主要依靠親和力優(yōu)化的或者是純天然的TCR識(shí)別腫瘤MHC分子呈遞的抗原���,通過(guò)TCR-CD3復(fù)合物向胞內(nèi)傳遞刺激信號(hào)。因此���,TCR-T不光能夠識(shí)別腫瘤表面的抗原�,更能夠識(shí)別腫瘤內(nèi)部成百上千個(gè)抗原。正是這點(diǎn)����,使TCR-T更適合應(yīng)用于實(shí)體瘤治療。
(2) 此外由于CAR-T療法在臨床應(yīng)用過(guò)程中面臨的最大挑戰(zhàn)就是其毒副作用�����,如細(xì)胞因子釋放綜合征(CRS)和免疫效應(yīng)細(xì)胞相關(guān)性神經(jīng)毒性綜合征(ICANS)����。而TCR-T的TCR更多是天然全人源的,從根本上降低了細(xì)胞毒性的風(fēng)險(xiǎn)�。
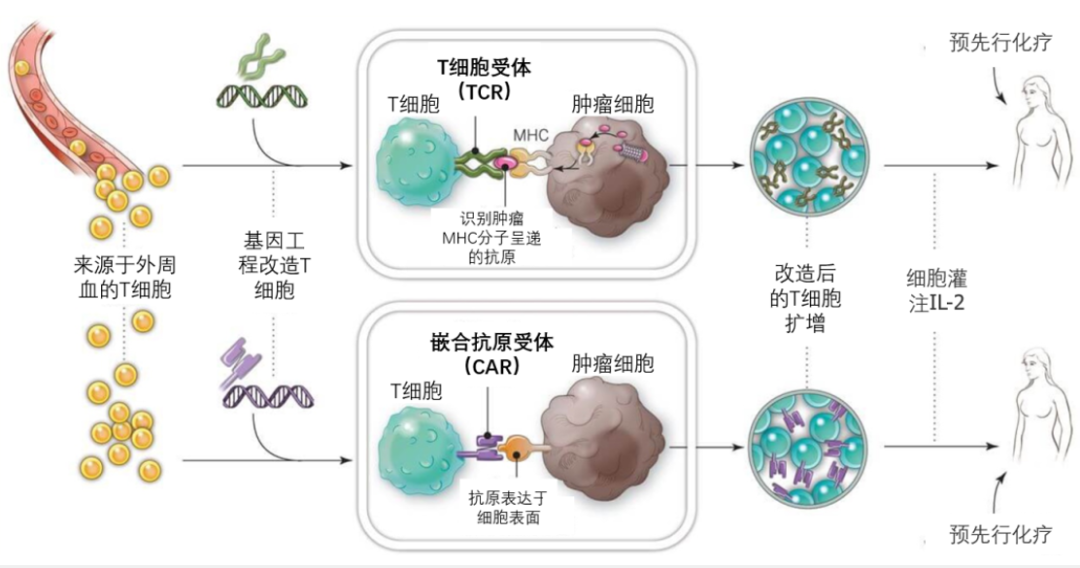
圖3 TCR-T細(xì)胞療法與CAR-T細(xì)胞療法區(qū)別示意圖
三、mRNA技術(shù)應(yīng)用于TCR-T細(xì)胞療法
最早工程化T細(xì)胞主要通過(guò)逆轉(zhuǎn)錄病毒或慢病毒將TCR或CAR引入自體或同種異體T細(xì)胞���,然后體外擴(kuò)增�����。然而����,這種類(lèi)型的病毒轉(zhuǎn)導(dǎo)使受體細(xì)胞面臨基因突變的風(fēng)險(xiǎn)��。鑒于此,mRNA編碼CAR或TCR用于工程化T細(xì)胞的策略?xún)?yōu)于病毒����,因?yàn)槠涓咿D(zhuǎn)染率和無(wú)基因突變的風(fēng)險(xiǎn)(圖4a)。在很多研究中��,mRNA-CAR的電穿孔已經(jīng)被用作病毒轉(zhuǎn)染的新替代方案�。由于編碼CAR或TCR的mRNA在有限的時(shí)間內(nèi)(約1周)表達(dá)���,這需要患者在每個(gè)治療周期內(nèi)重復(fù)注射mRNA CAR-T�,以保持CAR在體內(nèi)的連續(xù)表達(dá)����。修改mRNA的結(jié)構(gòu)以提高穩(wěn)定性和翻譯效率可以有效延長(zhǎng)CARs或TCRs的表達(dá),減少重復(fù)劑量的需要�����。盡管基于mRNA的體外工程化CAR-T或TCR-T細(xì)胞具有在T細(xì)胞表面產(chǎn)生高水平編碼的CAR或TCR的優(yōu)點(diǎn)�,但得到的工程化T細(xì)胞是個(gè)體化的細(xì)胞治療產(chǎn)品,需要從患者身上提取T細(xì)胞�,并且需要昂貴且耗時(shí)的制備程序。為了克服這些挑戰(zhàn)��,可以通過(guò)靜脈注射給藥靶向編碼CAR或TCR的mRNA納米顆粒的T細(xì)胞,從而在體內(nèi)產(chǎn)生CAR或TCR工程化的T細(xì)胞(圖4b)�。

圖4mRNA編碼CAR和TCR工程化T細(xì)胞的體外和體內(nèi)遞送
參考文獻(xiàn):
[1].Engineered TCR-T CellI mmunotherapy in Anticancer Precision Medicine: Pros and Cons. Front Immunol. 2021;12: 658753.
[2]. Evolution of CD8+T Cell Receptor(TCR) Engineered Therapies for the Treatment of Cancer. Cells. 2021 Sep;10(9): 2379.
即日起-2023年10月31日,為助力國(guó)自然mRNA課題�,愛(ài)必信特推出mRNA定制合成&標(biāo)準(zhǔn)工具mRNA雙重優(yōu)惠活動(dòng)可供廣大客戶(hù)選擇,部分低至46折?���。?
活動(dòng)一 mRNA定制合成IVT優(yōu)惠項(xiàng)目
類(lèi)別
IVT最低量
目錄價(jià)(元)
活動(dòng)價(jià)(元)(65折)
國(guó)自然價(jià)(元)(55折)
線性mRNA
200ug/條
8700
5655
4785
環(huán)狀mRNA
200ug/條
15000
9750
8250
自復(fù)制mRNA
200ug/條
15000
9750
8250
活動(dòng)二 標(biāo)準(zhǔn)工具mRNA優(yōu)惠項(xiàng)目
本次活動(dòng)工具mRNA產(chǎn)品信息
分類(lèi)
貨號(hào)
產(chǎn)品名稱(chēng)
修飾堿基
純度
線性mRNA
EGFP mRNA
N1-Methylpseudo-UTP
>95%
環(huán)狀mRNA
Endless eGFP mRNA
—
>80%
不同規(guī)格工具mRNA價(jià)格
分類(lèi)
規(guī)格
目錄價(jià)(元)
活動(dòng)價(jià)(元)(54折)
國(guó)自然價(jià)(元)(46折)
線性mRNA
100ug
1500
813
688
環(huán)狀mRNA
100ug
3000
1625
1375